Kerja
enzim dipengaruhi oleh faktor lingkungan, yaitu sebagai berikut.
Suhu
Pada
suhu yang lebih tinggi, kecepatan molekul substrat meningkat, sehingga pada
saat bertumbukan dengan enzim, energi molekul substrat berkurang. Hal ini
memudahkan terikatnya molekul substrat pada sisi aktif enzim. Aktivitas enzim
meningkat dengan meningkatnya suhu sampai pada titik tertentu.
Pada
beberapa enzim, peningkatan suhu sampai 40° C diiringi dengan peningkatan
kecepatan reaksi. Hal ini berhubungan dengan meningkatnya energi kinetik pada
molekul substrat dan enzim. Pengaruh suhu (T) pada kecepatan reaksi dapat
dijelaskan melalui suatu koefisien suhu (Q10).
Grafik
pada menunjukkan hubungan suhu dan kecepatan reaksi enzim. Berdasarkan grafik
tersebut, jika dipilih sembarang suhu (T) misalnya sebesar 20° C pada suatu
kecepatan reaksi enzim tertentu, Q10 adalah sebagai berikut.
Koefisien
suhu (Q10 = 2) di atas menunjukkan bahwa kecepatan reaksi enzim
meningkat dua kalinya setiap peningkatan suhu 10°C. Namun, tidak berarti bahwa
peningkatan kecepatan reaksi berlangsung tidak terbatas. Seperti terlihat pada
grafik, kecepatan enzim mengkatalis reaksi mencapai suatu puncaknya pada suhu
tertentu. Suhu ini disebut suhu optimum suatu reaksi. Pada grafik dapat dilihat
bahwa suhu optimum reaksi yang dikatalis enzim adalah‘40° C. Di atas suhu
tersebut, produk yang dihasilkan menurun. Peningkatan suhu di atas suhu optimum
menyebabkan putusnya ikatan hidrogen dan ikatan lain yang merangkai molekul
enzim, sehingga enzim mengalami denaturasi.
 |
| Suhu Optimum Enzim |
Denaturasi
adalah rusaknya bentuk tiga dimensi enzim yang menyebabkan enzim tidak dapat
lagi berikatan dengan substratnya (Gambar 2.6b). Denaturasi menyebabkan
aktivitas enzim menurun atau hilang. Denaturasi umumnya bersifat irréversible
(tidak dapat kembali). Namun, enzim-enzim yang langka seperti RNAase dapat
mengalami renaturasi setelah mengalami denaturasi. Renaturaslfadalah kembalinya
bentuk enzim yang rusak ke bentuk sebelum rusak.
 |
| Denaturasi Enzim - Pemanasan dengan suhu tinggi mengubah struktur enzim dan merusak sis aktif enzim |
pH
Derajat
keasaman (pH) juga mempengaruhi aktivitas enzim. Perubahan kondisi asam dan
basa di sekitar molekul enzim mempengaruhi bentuk tiga dimensi enzim dan dapat
menyebabkan denaturasi enzim. Setiap enzim memiliki pH optimum. Sebagai contoh,
pepsin (enzim yang bekerja di dalam lambung) memiliki pH optimum sekitar 2
(sangat asam), sedangkan amilase (enzim yang bekerja di mulut dan usus halus)
memiliki pH optimum sekitar 7,5 (agak basa).
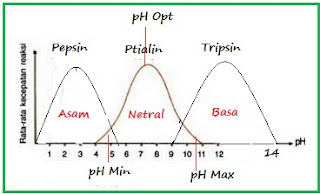 |
| pH optimum pada beberapa jenis enzim |
Aktivator
dan Inhibitor
Aktivator
merupakan molekul yang mempermudah ikatan antara enzim dengan substratnya.
Contoh aktivator adalah ion klorida yang berperan dalam aktivitas amilase dalam
saliva. Sebaliknya, inhibitor merupakan suatu molekul yang menghambat ikatan
enzim dengan substratnya. Contoh inhibitor adalah ion sianida. Ion sianida
menutupi sisi aktif enzim yang terlibat dalam respirasi.
 |
| Inhibitor Enzim : Inhibitor kompetitif dan inhibitor non kompetitif |
Ada
dua macam inhibitor enzim, yaitu inhibitor kompetitif dan inhibitor
non-kompetitif.
- Inhibitor kompetitif
Inhibitor kompetitif adalah molekul penghambat yang cara kerjanya bersaing dengan substrat untuk mendapatkan sisi aktif enzim. Contohnya, sianida bersaing dengan oksigen untuk mendapatkan hemoglobin dalam rantai respirasi terakhir. Inhibitor kompetitif dapat diatasi dengan cara penambahan konsentrasi substrat. - Inhibitor non-kompetitifInhibitor non-kompetitif adalah molekul penghambat enzim yang bekerja dengan cara melekatkan diri pada luar sisi aktif, sehingga bentuk enzim berubah, dan sisi aktif tidak dapat berfungsi. Inhibitor ini tidak dapat dipengaruhi oleh konsentrasi substrat.
Konsentrasi
Enzim
Konsentrasi
enzim juga mempengaruhi kecepatan reaksi. Semakin besar konsentrasi enzim
semakin cepat pula reaksi yang berlangsung. Dengan kata lain, konsentrasi enzim
berbanding lurus dengan kecepatan reaksi.
 |
| Pengaruh konsentrasi enzim terhadap kecepatan reaksi |
Sisi
aktif suatu enzim dapat digunakan berulang kali oleh banyak substrat. Substrat
yang berikatan dengan sisi aktif enzim akan membentuk produk. Pelepasan produk
menyebabkan sisi aktif enzim bebas untuk berikatan dengan substrat lainnya.
Oleh karenanya hanya dibutuhkan sejumlah kecil enzim untuk mengkatalis sejumlah
besar substrat.
Konsentrasi
Substrat
Bila
jumlah enzim dalam keadaan tetap, kecepatan reaksi akan meningkat dengan adanya
peningkatan konsentrasi substrat. Namun, pada saat sisi aktif semua enzim
bekerja, penambahan substrat tidak dapat meningkatkan kecepatan reaksi enzim
lebih lanjut. Kondisi ini disebut konsentrasi substrat pada titik jenuh atau
disebut dengan kecepatan reaksi telah mencapai maksimum (Vmax).
 |
| Pengaruh konsentrasi substrat terhadap kecepatan reaksi |
Banyaknya
molekul substrat yang diubah menjadi produk oleh enzim sangat bervariasi.
Jumlah pergantian substrat adalah banyaknya molekul substrat yang dapat diubah
menjadi produk oleh satu molekul enzim selama satu menit.
Pengaruh
konsentrasi substrat terhadap aktivitas enzim dapat diketahui langsung dengan
melakukan. Substrat yang digunakan berupa hidrogen peroksida (H2O2).
Hidrogen peroksida alami merupakan produk sampingan yang tidak diinginkan dari
metabolisme aerob, misalnya pemecahan asam amino dan asam lemak. Hidrogen
peroksida merupakan senyawa yang sangat reaktif dan dapat merusak sel. Oleh
karenanya hidrogen peroksida dikumpulkan di dalam peroksisom, kemudian
didegradasi oleh katalase. Katalase mendegradasi hidrogen peroksida menjadi air
(H2O) dan oksigen (O2) dengan reaksi sebagai berikut.
2H2O2 ------> 2H2O + O2
2 comments:
wah kak keren banget tampilannya gemas, udah gitu ulasan materinya lebih ringan jadi bahasanya mudah dipahami. thanks kak
sangat membantu kak terimakasih
Post a Comment